Webinaires
Pourquoi les poudres se comportent mal
Agrégation, agglomération, solidification pendant le stockage, adhérence aux machines : si vous travaillez avec des poudres, vous avez certainement déjà été confronté à ces problèmes évidents.
Mais vous n'avez peut-être pas conscience des dangers que peut présenter la poudre malicieuse ailleurs. Ces problèmes moins visibles et moins connus peuvent avoir des conséquences graves, comme des risques pour la santé et des rappels de produits. Ignorez-les à vos risques et périls.
Rejoignez Mary Galloway, directrice du laboratoire de recherche et développement alimentaire METER, et le Dr Zachary Cartwright, scientifique alimentaire en chef, qui présenteront les résultats de leurs dernières recherches et expliqueront les nombreuses raisons pour lesquelles les poudres se comportent de manière imprévisible.
Vous apprendrez :
- Combien d'entreprises présentent accidentellement de manière trompeuse les bienfaits fonctionnels de leurs produits alimentaires ?
- Les risques microbiologiques liés aux aliments à faible teneur en humidité et les idées fausses dangereuses à leur sujet
- Les nombreux facteurs qui influencent la stabilité de la poudre et ceux qu'il est le plus important de surveiller
- Comment identifier les sources potentielles de problèmes liés à la poudre et comment les prévenir avant qu'ils ne surviennent
À propos des présentateurs
Mary Galloway est directrice du laboratoire de recherche et développement alimentaire METER. Elle est spécialisée dans l'utilisation et le test d'instruments qui mesurent l'activité de l'eau et son influence sur les propriétés physiques. Elle a travaillé avec des dizaines de marques alimentaires parmi les plus importantes et les plus prospères au monde afin de résoudre des problèmes liés à l'humidité dans leurs produits.
Le Dr Zachary Cartwright est responsable scientifique en alimentation chez METER Group. Il est titulaire d'un doctorat en sciences alimentaires de l'université de l'État de Washington et d'une licence en biochimie de l'université d'État du Nouveau-Mexique. Il est expert en analyse isotherme et en utilisation de l'analyseur de sorption de vapeur (VSA).

Transcription, modifiée pour plus de clarté
Zachary :
Bonjour à tous. Bienvenue dans « Pourquoi les poudres se comportent mal ». Je m'appelle Zachary Cartwright.
Marie :
Et je suis Mary Galloway.
Zachary :
Commençons par un bref aperçu de ce qui vous attend aujourd'hui. Nous allons parler de ce que sont les poudres, essayer de vous en donner une définition, puis nous nous concentrerons principalement sur trois aspects différents des poudres. Nous examinerons la stabilité physique, comme l'agglomération, la formation de grumeaux et la perte de fluidité. Mary a des données de laboratoire qu'elle va partager avec nous, puis nous passerons à la stabilité chimique, en réfléchissant à la rancidité ou aux réactions de brunissement. Je crois que vous avez également des recherches à nous présenter.
Marie :
Oui. Nous avons mené une étude en laboratoire sur la dégradation de la vitamine C.
Zachary :
Enfin, nous examinerons la stabilité microbienne. Même s'il s'agit d'un environnement à faible activité hydrique, il existe tout de même certains risques microbiens, et je crois que vous venez de travailler sur un article ou que vous avez été cité dans un article sur lequel nous allons nous concentrer.
Poudres 101 : principes fondamentaux et définitions
Zachary :
Mary, qu'est-ce qu'une poudre ? Comment définiriez-vous une poudre ?
Marie :
Eh bien, la plupart des gens savent ce qu'est une poudre en théorie, car on en trouve partout. Lorsque nous en avons discuté précédemment, le marché avait son importance. Lorsque nous avons parlé de la catégorie des poudres, nous avons évoqué les épices et les ingrédients. L'industrie pharmaceutique utilise également ce terme pour désigner les excipients et les API, qui remplissent de nombreuses fonctions différentes.
Fondamentalement, une poudre est un produit granulaire de petite taille. Nous avons trouvé une bonne définition dans un article de Bandari datant de 2017. Pour paraphraser, cet article explique que la structure est la principale caractéristique d'une poudre. Elle peut être amorphe, cristalline ou une combinaison des deux. La manière dont ces deux caractéristiques interagissent, ainsi que la taille des particules, ont une incidence sur la fonctionnalité, l'application et la production de la poudre.
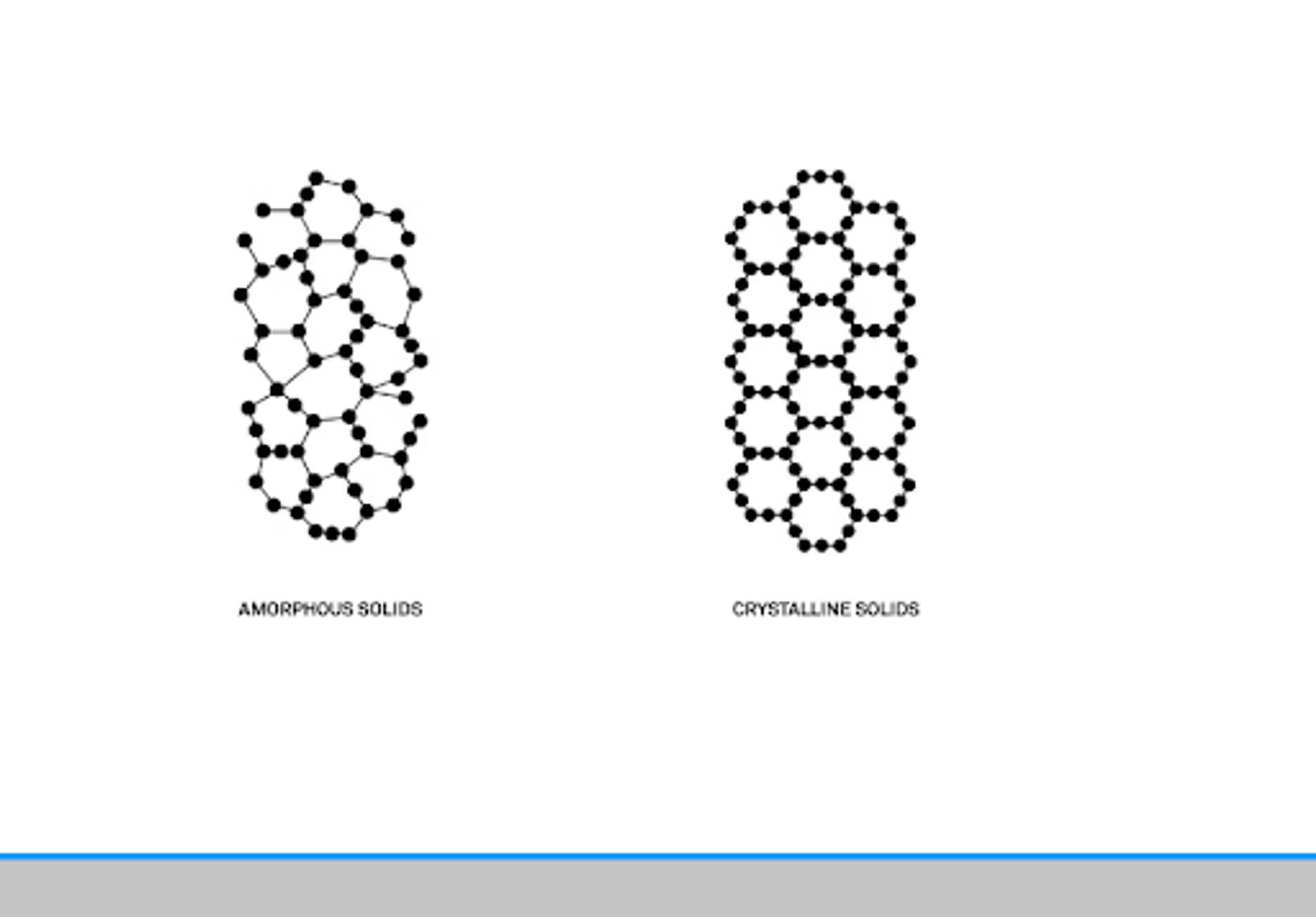
Cela résume pourquoi les poudres constituent un marché aussi vaste et pourquoi elles sont si difficiles à appréhender : elles couvrent en effet de nombreux marchés et groupes fonctionnels différents.
Zachary :
Nous avons déjà organisé un webinaire sur les poudres, au cours duquel nous avons approfondi la question des structures amorphes et cristallines. D'un point de vue moléculaire, il existe essentiellement quelques différences fondamentales. Une structure cristalline présente une structure répétitive bien définie. C'est quelque chose que l'on peut observer au niveau moléculaire. Même visuellement, ces différences sont perceptibles dans les poudres, et nous avons quelques illustrations à ce sujet.
La dernière fois, nous avons parlé du mélange de ces poudres et examiné certains des effets combinés. Si vous souhaitez en savoir plus à ce sujet, vous pouvez revoir notre précédent webinaire. Nous avons également abordé la question de la taille des particules, et j'aimerais revenir plus en détail sur ce point. Comment la taille des particules influe-t-elle sur certaines caractéristiques des poudres ?
Marie :
La taille des particules a un impact majeur sur les caractéristiques des poudres et explique pourquoi elles peuvent être si difficiles à manipuler. Lorsque les particules sont de petite taille, elles peuvent former des ponts entre elles de manière imprévisible, ce qui peut les rendre collantes et entraîner leur agglomération, entre autres.
Il y a plusieurs facteurs à prendre en compte, outre la taille générale des particules. La forme des particules est également un facteur important. Des recherches ont également montré que lorsque vous mélangez des poudres cristallines, vous obtenez ce que l'on appelle la déliquescence, qui consiste essentiellement à passer d'un état solide à un état liquide plus tôt que ce à quoi vous vous attendriez pour chacune des poudres prises individuellement. Cela s'explique par la différence de taille des particules.
Lorsque vous obtenez ces points de contact, vous pouvez commencer à avoir des problèmes de pontage. Les poudres cristallines peuvent être particulièrement délicates car, comme vous l'avez dit, elles ont une structure très ordonnée, ce qui signifie que l'humidité n'adhère essentiellement qu'à l'extérieur de la structure. Il s'agit uniquement d'une interaction superficielle, contrairement à une poudre amorphe, qui présente de nombreuses crevasses et des formes et tailles irrégulières, et où l'eau peut plus facilement se lier à l'amorphe. Cela les rend fonctionnellement différentes, mais cela a également un impact lorsque vous devez les utiliser en tant que formulateur.
Zachary : La dernière fois, nous avons examiné les cinq étapes du compactage. Il y a plusieurs étapes avant d'arriver à l'agglomération, puis finalement à la liquéfaction.
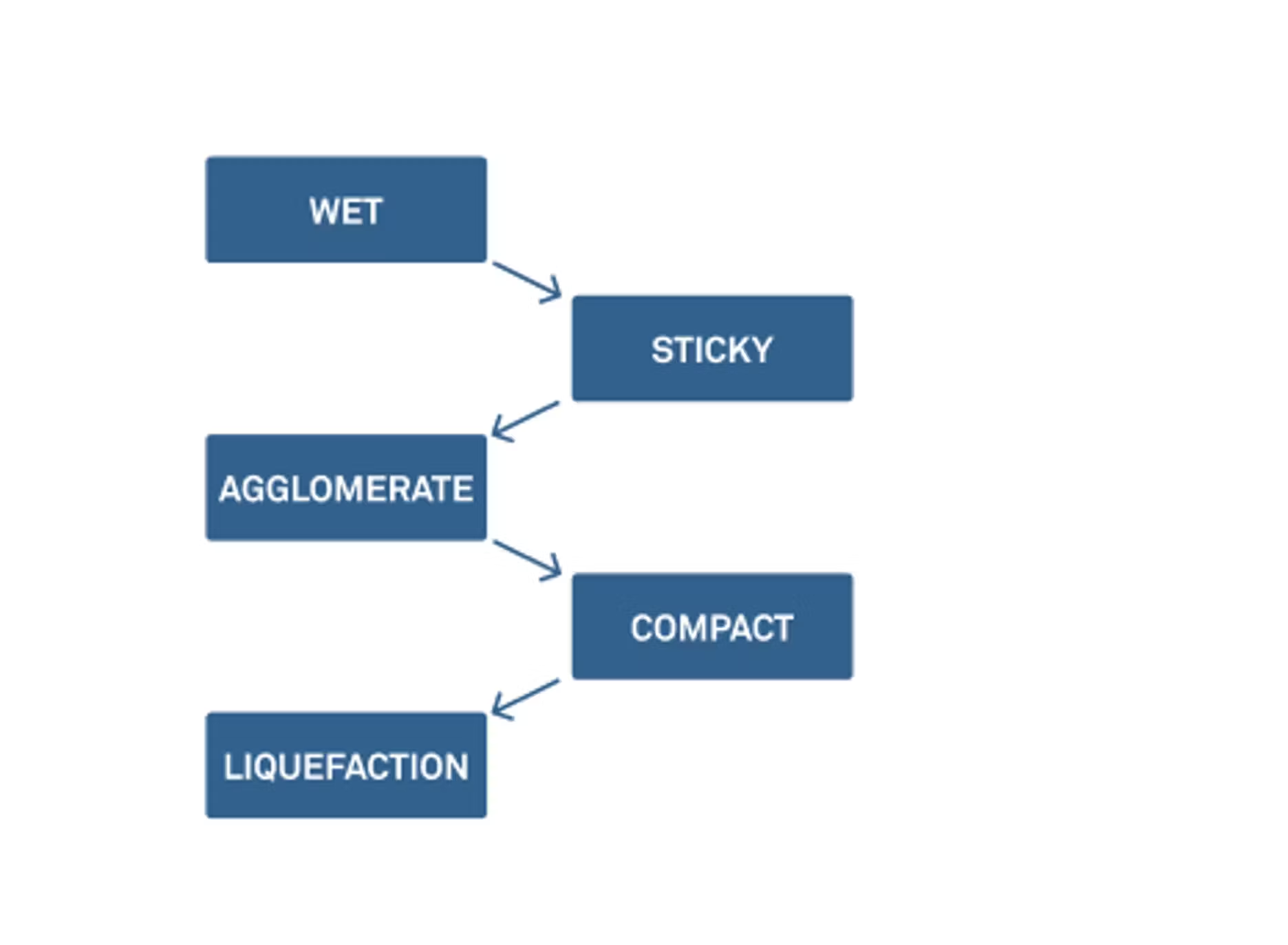
Nous n'avons pas nécessairement besoin de les passer en revue aujourd'hui, mais je tiens à souligner que l'agglomération et la formation de grumeaux peuvent commencer à se produire à un stade précoce. Une façon de contrôler ce phénomène consiste à examiner l'humidité et l'activité de l'eau de ces poudres. Nous le faisons dans la plupart de nos webinaires, mais il est toujours utile de définir ce que sont la teneur en humidité et l'activité de l'eau, et d'expliquer comment nous pouvons utiliser ces éléments ensemble pour réfléchir aux changements physiques et à la stabilité chimique et microbienne.
Commençons par examiner la teneur en humidité et l'activité de l'eau. Je sais que vous avez un graphique très clair à ce sujet et une bonne définition. Comment faites-vous la différence entre ces deux mesures différentes ?
Marie :
Pour certaines des personnes à qui nous parlons, l'activité de l'eau est un concept nouveau, et la plupart des gens connaissent très bien la teneur en humidité. J'aime bien les distinguer et dire qu'il existe deux mesures de l'eau que nous pouvons effectuer. L'une consiste à examiner la quantité d'eau, ou la teneur en humidité. L'autre consiste à examiner l'énergie de l'eau : que peut faire l'eau ? Nous mesurons ces deux éléments de manière complètement différente.
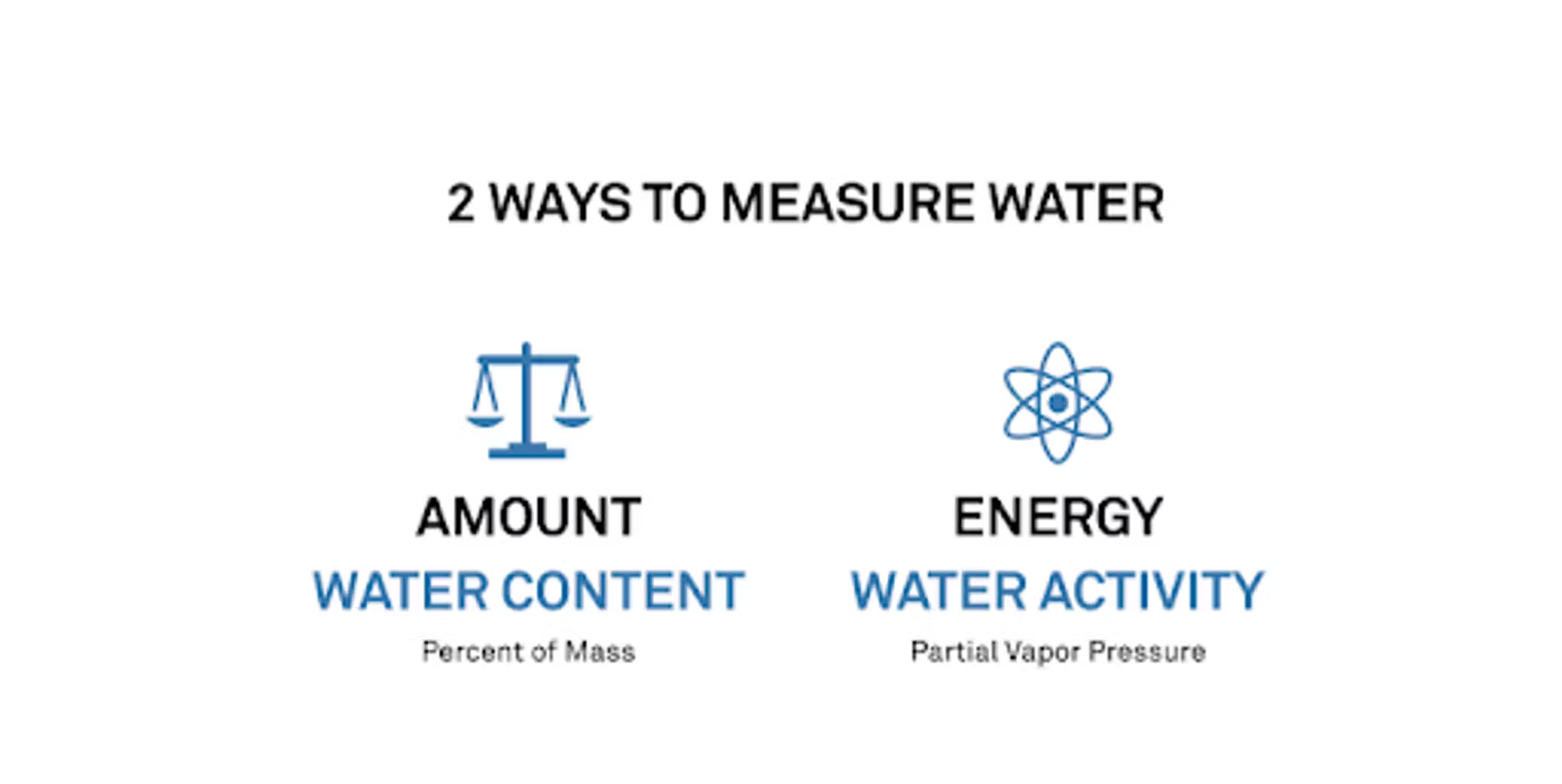
Lorsque nous examinons la teneur en humidité, il s'agit d'un pourcentage massique, nous examinons donc uniquement le poids. Mais lorsque nous examinons l'activité de l'eau, nous mesurons en fait ce que nous appelons la pression de vapeur, ce qui est similaire à l'humidité qui se dégage d'un échantillon.
Si vous souhaitez consulter certaines de nos recherches et certains de nos autres webinaires, nous y abordons la question de l'activité de l'eau. Il peut être utile de considérer que ce à quoi nous faisons référence est essentiellement une humidité équilibrée dégagée par l'échantillon, ce qui peut aider à mieux comprendre ces deux éléments. Il convient également de noter et de surveiller la manière dont certaines conditions externes et ambiantes peuvent affecter leur produit.
Zachary :
Bon point. Je constate encore souvent que l'activité de l'eau est définie à tort comme la disponibilité de l'eau, ce qui n'est pas tout à fait exact. L'activité de l'eau est un principe thermodynamique. Il s'agit en réalité de l'énergie de cette eau, et il est important de le savoir car l'énergie de l'eau peut être utilisée pour une réaction chimique, un changement de texture ou autre chose. Il est bon de se concentrer sur ce point. Nous examinons l'énergie de l'eau avec l'activité de l'eau.
Nous avons régulièrement des clients qui ont de bons résultats en matière de teneur en humidité, mais qui ont beaucoup de mal à obtenir des mesures précises. Comme ils ne peuvent pas déterminer avec précision la teneur en humidité, il leur est difficile d'établir un lien entre certains des problèmes auxquels ils sont confrontés et la teneur en humidité. La teneur en humidité seule ne vous donnera pas toutes les informations dont vous avez besoin, en particulier pour les poudres.
En combinant l'activité de l'eau et la teneur en humidité, nous pouvons examiner l'isotherme, ce dont nous parlons beaucoup, mais c'est parce que c'est une façon unique d'examiner l'eau dans ces produits et d'obtenir une image complète du comportement de l'eau dans ce produit. Comment prendre un isotherme ? Comment examiner cette forme et la corréler aux différentes caractéristiques d'une poudre ?
Marie :
Nous utilisons les isothermes notamment pour définir un point critique, une activité critique de l'eau à partir de laquelle nous commençons à observer des changements de texture et d'autres modifications dans la structure du produit. En gros, à partir de quel moment le produit commence-t-il à changer et à absorber beaucoup plus d'humidité ? En général, s'il s'agit d'une poudre, c'est à ce moment-là que vous commencez à observer des agglomérats et des grumeaux. S'il s'agit d'un autre produit, comme une collation, celui-ci peut commencer à ramollir. Il est donc essentiel de déterminer ces points critiques. Nous pouvons également examiner la pente ou la forme de l'isotherme elle-même et identifier la structure, comme nous l'avons vu pour les produits amorphes et cristallins. Nous pouvons examiner cela. Nous pouvons également exposer ces échantillons à de l'air humide et observer leur comportement en temps réel, ce qui nous permet d'obtenir de nombreuses informations utiles sur ce produit pour un client.
Zachary :
Il est important de souligner que nous disposons d'une méthode unique appelée « isotherme dynamique du point de rosée », qui constitue le meilleur moyen d'obtenir un graphique ou une image haute résolution du comportement de l'eau. Il existe d'autres méthodes dont nous parlerons plus tard, mais l'utilisation de cette isotherme dynamique du point de rosée et de l'analyseur d'absorption de vapeur est le meilleur moyen de caractériser l'eau, puis d'examiner certains des facteurs que nous allons prendre en compte, à commencer par la stabilité physique. Dans la section suivante, nous aborderons la stabilité physique et ce qu'elle signifie pour les poudres.
Marie :
Très bien.
Caractérisation de la stabilité physique des poudres
Zachary :
Approfondissons la question de la stabilité physique. Lorsque nous pensons à la stabilité physique et aux poudres, trois facteurs principaux doivent être pris en compte : l'humidité, la température et le temps. Je vous laisse approfondir ces points et les compléter si nécessaire.
Marie :
En ce qui concerne l'humidité, en gros, si nous disposons de plus d'humidité, nous aurons plus de processus à modifier, plus de structures à modifier. Lorsque vous avez parlé du DDI, ma première pensée a été de considérer cela en termes de lait en poudre séché par atomisation, où nous passons d'un état vitreux à un état caoutchouteux.
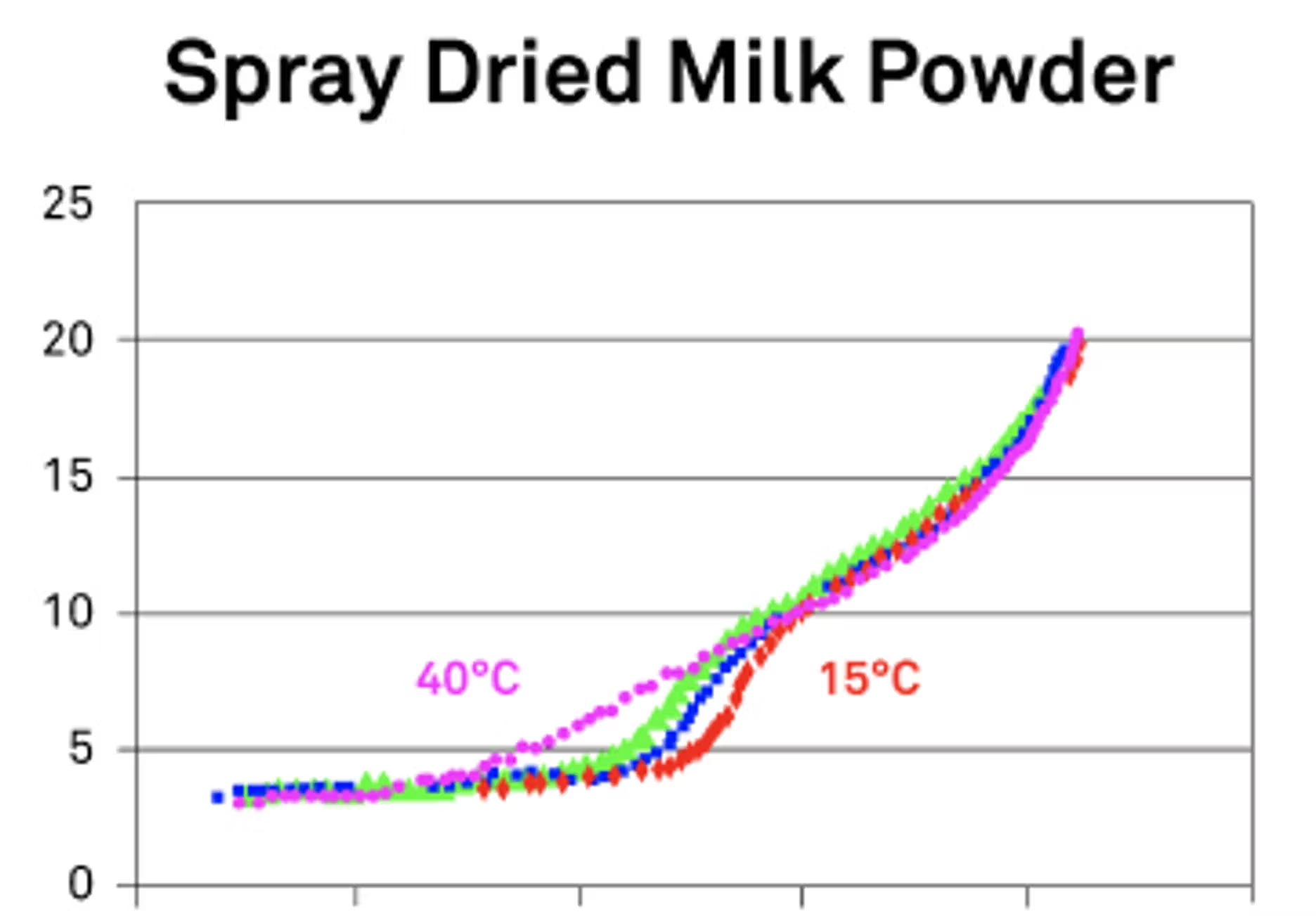
Maintenant, si nous utilisions un style d'isotherme différent, plus traditionnel, vous manqueriez en fait cette transition, car elle serait essentiellement ignorée. Normalement, on maintient les éléments à un certain taux d'humidité et on observe ce qui se passe. Mais avec le DDI, le processus se déroule en temps réel et on peut réellement voir ces transitions se produire. C'est précisément ce que j'entends lorsque je parle d'utiliser les isothermes pour pouvoir voir vos données en temps réel et savoir quand ces points critiques commencent à se produire. L'humidité a un impact majeur sur ces processus, car l'eau a tendance à accélérer les choses.
Il peut s'agir d'un solvant, d'un réactif, voire d'un tampon dans les réactions chimiques. Parfois, les rôles changent au fur et à mesure que le processus avance ou que davantage d'humidité est ajoutée à ce processus, et vous pouvez alors observer des vitesses de réaction différentes qui changent réellement. Outre l'humidité, nous voulons également examiner la température. Nous aimons montrer un graphique qui illustre parfaitement comment le point critique dont nous avons parlé évolue lorsque nous ajoutons de la chaleur ou augmentons la température d'un produit. Ce qui se passe, et c'est tout à fait logique quand on y réfléchit, c'est que ce changement se produit plus rapidement. Vous ajoutez de l'énergie au système, et ce système s'écoule plus rapidement. Vous obtiendrez ces changements à des activités de l'eau plus faibles ou plus rapides dans ce processus.
La dernière chose, c'est le temps. Si vous laissez suffisamment de temps à un processus, il va changer. Même si vous pouviez maintenir les autres éléments à une température et un taux d'humidité constants, si vous laissiez suffisamment de temps, cela se produirait. Je pensais justement à cet exemple l'autre jour. Prenez de vieilles fenêtres en verre : si vous mesuriez le haut et le bas de fenêtres en verre très anciennes, vous constateriez que le bas est plus épais que le haut, car elles ont eu beaucoup de temps pour s'écouler. C'est l'idée selon laquelle si vous laissez suffisamment de temps à un processus, il aboutira. Ces trois facteurs influent sur la stabilité physique.
Zachary :
Il est également important de noter que, selon votre question, vous pouvez utiliser différentes méthodes ou différents types d'isothermes. Pour en revenir à l'isotherme dynamique du point de rosée, vous pouvez l'utiliser pour trouver ce point critique et comprendre exactement à quelle activité de l'eau ou à quelle combinaison d'humidité relative et de température cet effet se produira. Une fois que vous savez où se trouve ce point critique, vous pouvez également effectuer un test DVS, un test d'absorption dynamique de vapeur, pour répondre à la question relative au temps.
Pour revenir à votre exemple de fenêtre, combien de temps faudra-t-il pour atteindre ce point critique dans certaines conditions ? Nous avons un moyen d'y répondre. Nous disposons d'un analyseur d'absorption de vapeur qui vous permet d'utiliser ces deux méthodes. Il s'agit d'un instrument unique, le seul capable de réaliser ces deux types de tests. Si vous rencontrez un problème de stabilité physique, il peut être utile d'avoir accès à ces deux types de tests.
Passons maintenant à votre projet de mélange d'épices. En quoi consistait ce projet ? Quel était son objectif et qu'avez-vous appris grâce à lui ?
Marie :
Comme nous le savons, l'humidité se déplace en raison des différences d'activité de l'eau. La question est de savoir dans quelle mesure elle se déplace. Pouvons-nous le prédire et quelle est la précision de cette prédiction ? Nous disposons d'un outil. Il existe certainement des équations qui tentent de modéliser cette interaction entre les produits. Pour notre projet, j'ai essentiellement pris six mélanges différents, certaines épices, certains mélanges de maltodextrine dans du sorbitol, de l'amidon de maïs et du sel d'oignon, puis certaines épices, de la sauge, de l'origan et du cumin. Nous les avons mélangés. Tout d'abord, nous les avons tous soumis à une activité de l'eau très spécifique. Ensuite, nous avons également effectué des isothermes sur tous ces ingrédients, car il s'agit d'un facteur important, non seulement l'activité de l'eau de départ ou le rapport massique dans le sang, mais aussi les caractéristiques de cette isotherme et son comportement en présence d'humidité.
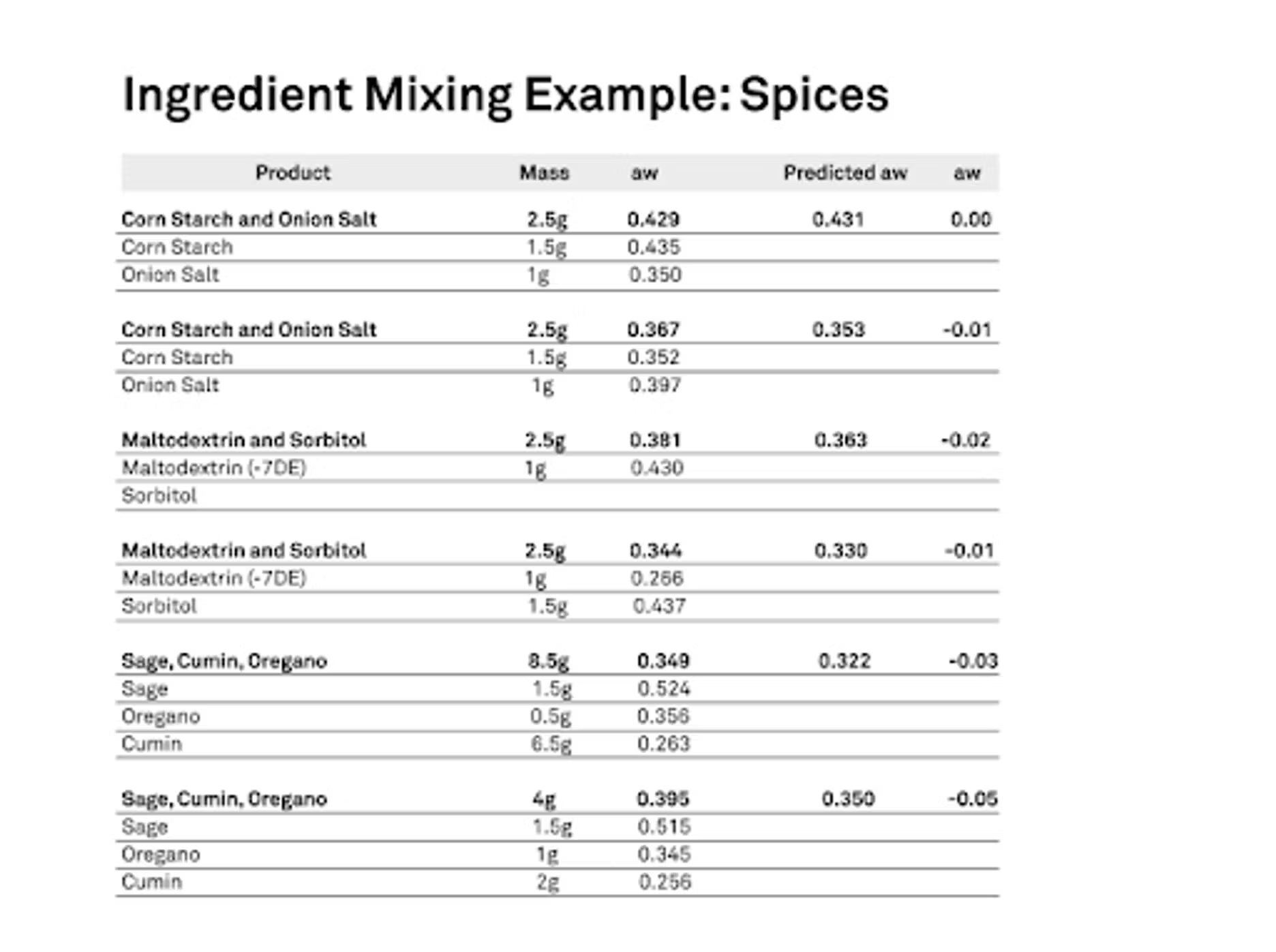
Nous voulons savoir comment ils absorbent ou non, ou quelle que soit la manière dont cela se passe. Nous avons besoin de connaître ces informations pour ce produit afin de pouvoir établir un bon modèle prédictif. Nous avons fait cela, puis nous les avons mélangés dans des proportions massiques connues. Ensuite, nous avons mesuré l'activité de l'eau après leur avoir laissé le temps de s'équilibrer. Nous avons également fait des prévisions, qui se sont avérées très bonnes. Je vous montre les combinaisons que nous avons réalisées, celle du haut, avec de l'amidon de maïs et du sel d'oignon. Nous avons mélangé un gramme et demi de fécule de maïs, et l'activité de l'eau était initialement de 0,435. Pour le sel d'oignon, nous avons utilisé un gramme, mais l'activité de l'eau était plus faible. Vous pouvez voir ici que l'activité de l'eau était initialement de 0,35, puis nous avons mélangé les deux et l'activité réelle de l'eau de notre mélange était de 0,429.
Lorsque nous avons exécuté le modèle prédictif qui tenait compte des isothermes, de la masse initiale et des activités initiales de l'eau, nous avons en fait prédit que l'activité finale de l'eau serait de 0,431, ce qui est extrêmement proche. Cela a bien fonctionné. Ces produits ont en fait une taille de particules fine, ce qui leur confère de nombreux contacts, ce qui permet d'obtenir un équilibre plus rapide. Ce n'était pas vraiment une surprise, mais c'était agréable de voir que cela fonctionnait si bien. Vous pouvez voir avec certains de nos autres exemples que nous avons très bien fonctionné. Nous avons également utilisé de la maltodextrine et du sorbitol. Nous avons varié les quantités, nous avons varié leur point de départ. L'un était plus élevé que l'autre, puis nous les avons intervertis. Nous avons essayé différentes combinaisons pour simplement tester un peu. Ensuite, nous avons également ajouté les épices au fond : la sauge, le cumin et l'origan.
Cela a très bien fonctionné. Le pire scénario dans notre configuration était le tout dernier exemple. Je ne devrais peut-être pas le dire, mais le scientifique en moi m'oblige à le faire. Vous verrez que notre prévision était de 0,35 pour l'activité de l'eau, alors que la valeur réelle était de 0,395. Elle était inférieure d'environ 0,05. Je voulais simplement expliquer comment cela fonctionne, puis présenter les comparaisons que nous avons effectuées.
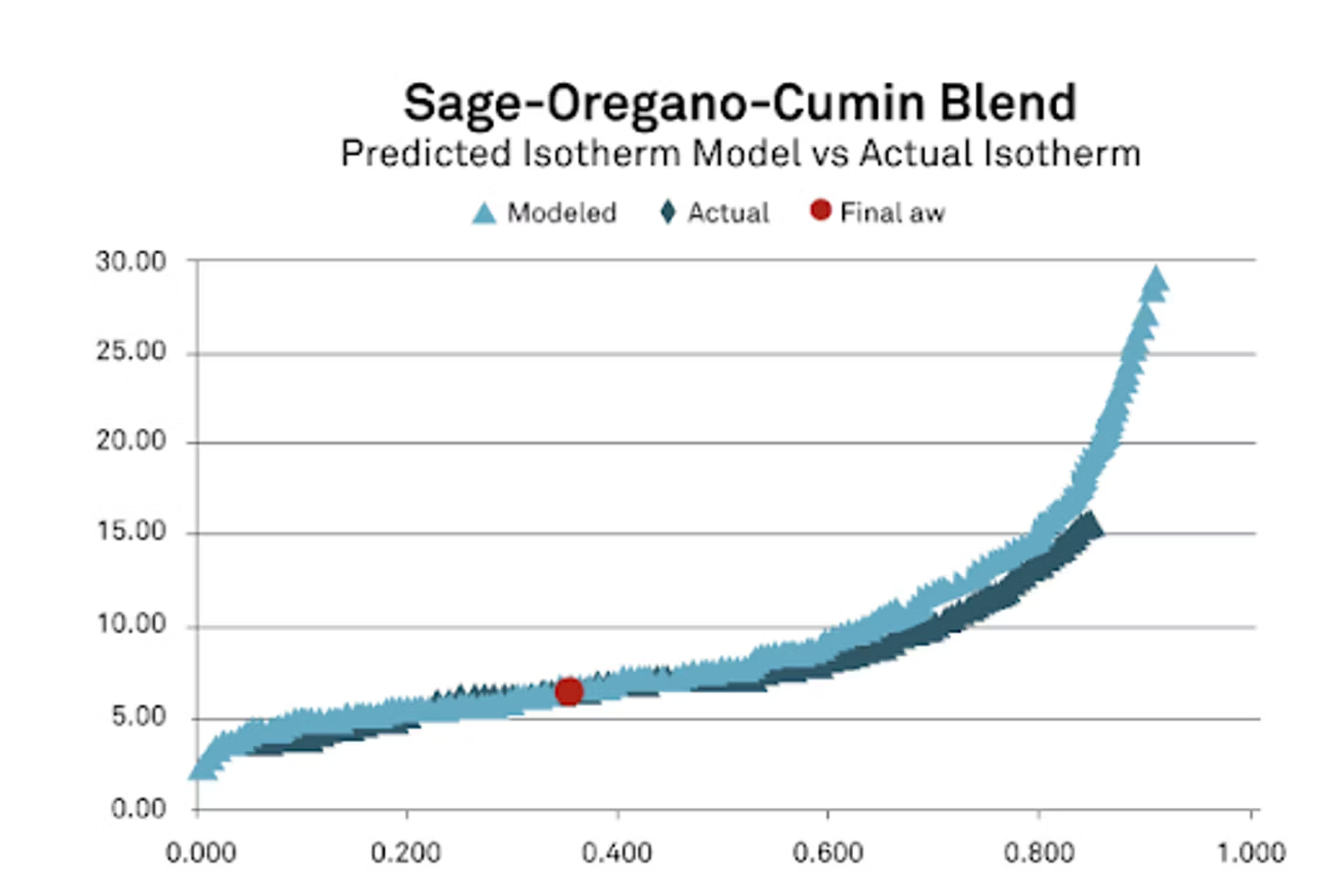
Vous verrez ici toutes les isothermes pour la sauge, le cumin, l'origan, un modèle combiné, donc là où nous avons tout mis ensemble. Je voulais également montrer où nous avons commencé. C'est là que nous avons commencé avec tous les ingrédients, avec l'activité initiale de l'eau, avec la teneur initiale en humidité basée sur l'isotherme et les rapports de masse. Une fois que nous avons tout mis là-dedans, vous pouvez voir que nous avons obtenu une activité finale de l'eau de 0,349.
Pour cela, l'important est de procéder mathématiquement, afin de nous assurer que nous disposons d'une bonne représentation, d'une bonne équation mathématique et de bons coefficients pour chacun de nos ingrédients. Une fois que nous avons obtenu cela, nous avons obtenu notre prédiction, qui était assez proche, ce qui m'a beaucoup satisfait. La taille des particules, peut-être avec les épices, n'était peut-être pas aussi bonne, il est possible qu'en les laissant ensemble plus longtemps, nous aurions pu obtenir un résultat légèrement différent. Mais j'étais très satisfait du résultat obtenu. Je voulais également prendre cela et l'examiner sous un autre angle.
Nous avons modélisé l'isotherme comme je le montre ici dans la courbe rouge, mais j'ai ensuite voulu la comparer avec l'isotherme réelle, car après avoir mélangé ce mélange, nous avons en fait effectué une isotherme dessus pour voir ce que nous pouvions faire. À partir de là, vous pouvez voir les différences entre l'isotherme réelle et l'isotherme modélisée, et elles correspondent très bien, en particulier dans la zone qui nous intéresse. Si nous recherchons des épices, peut-être entre 0,2 et 0,4, c'est généralement là qu'elles se trouvent dans la plage d'activité de l'eau. Vous remarquerez que nous avons un très bon ajustement. Je suis très satisfait des données de notre étude. Comme je l'ai dit, c'est le pire cas que nous ayons eu. Les autres ont en fait donné de bien meilleurs résultats.
Zachary :
Je voudrais prendre un peu de recul et réfléchir à l'application concrète de cette technologie. Je discute régulièrement avec des scientifiques qui subissent une forte pression pour commercialiser de nouveaux produits le plus rapidement possible. Si vous utilisez ce type de modélisation pour un mélange d'ingrédients secs, vous pouvez obtenir rapidement de nombreuses informations sur le produit final avant même de le fabriquer. Il faut certes un peu de temps pour constituer une bibliothèque et obtenir les isothermes de chaque ingrédient, mais une fois que c'est fait, vous pouvez vous asseoir devant votre ordinateur et comprendre très rapidement quelle sera l'activité de l'eau à l'équilibre. Grâce à notre nouveau programme dans la boîte à outils d'analyse de l'humidité fournie avec notre analyseur d'absorption de vapeur, le logiciel de la boîte à outils fait tout le travail à votre place. Vous avez mentionné ces équations et il y a des équations en arrière-plan, mais au lieu d'avoir à créer votre propre feuille de calcul ou à faire tout cela vous-même, tout ce travail est fait pour vous et il est facile de savoir quelle sera l'activité de l'eau à l'équilibre.
Vous pouvez désormais obtenir les coefficients pour le modèle que vous avez mentionné. À l'aide de ces coefficients, vous pouvez commencer à vous poser des questions telles que : quelle est la durée de conservation prévue ? Combien de temps faudra-t-il pour atteindre une activité de l'eau critique ? Quel type d'emballage dois-je utiliser ? Vous pouvez faire beaucoup de choses si vous prenez le temps d'examiner ces isothermes et de comprendre exactement comment utiliser ces données pour répondre à de nombreuses questions différentes. Je tiens simplement à souligner que les graphiques que vous présentez proviennent du logiciel Moisture Analysis Toolkit. Beaucoup de nos clients, qu'ils fabriquent des compléments alimentaires ou qu'ils travaillent avec certains des plus grands producteurs d'épices du pays, utilisent ces équations et ces outils pour accélérer leur production.
Marie :
Bon point. Je voudrais également ajouter qu'une fois que vous disposez des isothermes, je peux répéter cette prédiction à l'infini. Je peux modifier n'importe quelle partie et la relancer en quelques instants. Par exemple, je pourrais modifier le rapport de masse si nous trouvons que nous n'aimons pas particulièrement ce mélange, que nous n'aimons pas sa fluidité ou autre, ou peut-être que le goût n'est pas bon. Peut-être qu'il y a trop de cumin ou autre chose. Vous pouvez ajuster cette recette, et vous pouvez le faire directement dans le logiciel. Ou prenons un autre exemple : nous avons parlé dans des webinaires précédents de la saisonnalité, et de la façon dont elle peut modifier vos ingrédients entrants.
L'activité de l'eau a tendance à être plus élevée en été et plus faible en hiver. Il est important de surveiller ce que vous recevez à la livraison afin d'éviter toute surprise et toute humidité indésirable dans votre produit. C'est quelque chose que vous pouvez modifier ici. Vous pouvez modifier l'activité initiale de l'eau de n'importe lequel de ces produits, puis relancer la prédiction. Une fois que vous disposez de ces informations, vous pouvez les manipuler de nombreuses façons.
Zachary :
Tout cela concernait principalement la stabilité physique. Passons maintenant à la stabilité chimique et voyons comment nous pouvons utiliser l'activité de l'eau pour mieux comprendre la stabilité chimique.
Caractérisation de la stabilité chimique des poudres
Zachary :
Passons maintenant à la stabilité chimique. Je voudrais revenir sur le diagramme de stabilité que nous avons présenté précédemment.
La raison pour laquelle cela est important est que vous devez vous demander si votre poudre offre les bienfaits pour la santé qui ont été promis. Les vitamines sont-elles présentes comme promis ou y a-t-il eu un changement chimique dont vous devez tenir compte ? Si vous regardez le diagramme de stabilité, vous verrez qu'il existe différents points dans ce diagramme où les taux de dégradation ou les taux de réaction vont changer. Par exemple, autour d'une activité de l'eau de 0,6, vous pourriez observer une augmentation des réactions de brunissement. C'est lorsque l'activité de l'eau est très faible que l'oxydation des lipides commence à augmenter.
Il suffit de savoir comment l'activité de l'eau influe sur les vitesses de réaction et quelles réactions sont liées à la fin de la durée de conservation. Je sais que vous avez récemment travaillé sur une expérience concernant la vitamine C et que vous avez étudié son lien avec cette activité. Pouvez-vous nous expliquer cette expérience et ce que vous avez découvert ?
Marie :
Les vitesses de réaction chimique sont un peu plus compliquées à suivre, mais si vous pouvez les suivre, c'est faisable. Pour pouvoir suivre les vitesses de réaction, nous pouvons utiliser ces informations pour prédire une durée de conservation et un calendrier indiquant essentiellement le moment où elles atteignent un point où nous considérons que la durée de conservation est terminée. Notre étude portait sur l'acide ascorbique, que nous avons exposé à deux activités de l'eau différentes et à trois températures différentes. Nous avons ensuite suivi sa dégradation à l'aide d'un spectrophotomètre UV-Vis, ce qui nous a permis de calculer ces vitesses.
L'un des aspects essentiels à cet égard est que nous utilisions l'équation d'Arrhenius, qui est très couramment utilisée pour ce type de réaction. En gros, il s'agit de relier une vitesse à une température et à une énergie. Nous savons déjà que nous pouvons établir un lien entre l'énergie et l'activité de l'eau en particulier.
Nous menons une étude où nous commençons à zéro, puis, sur une période de plusieurs jours à plusieurs semaines, nous exposons cet acide ascorbique à une communauté et à une température spécifiques, puis nous observons son évolution et nous pouvons ensuite la représenter graphiquement. Voilà en quoi consiste notre étude. Essentiellement, nous aimerions savoir comment la température et l'activité de l'eau vont influencer le taux de dégradation. Nous avons ici ces graphiques temporels que nous montrons. Nous avons des activités de l'eau à 0,76 et 0,948, ainsi que les températures que nous avons utilisées, et nous menons ces études de manière accélérée. Nous avons 30 °C, 40 °C et 50 °C. Nous allons essentiellement entrer ces données dans la calculatrice et utiliser l'équation d'Arrhenius pour aider à extraire les informations et tout corréler. Une fois que nous aurons toutes nos données et les données de notre étude, nous pourrons indiquer au programme précisément ce qui nous intéresse.
Quelle température nous intéresse ? Quelle activité de l'eau nous intéresse ? Ensuite, nous devons également définir dans l'étude où nous allons fixer la fin de la durée de conservation. Quel pourcentage reste-t-il ? Dans notre cas, nous avons décidé que 75 % de la vitamine C restante marquerait la fin. Nous perdrions essentiellement 25 % de notre vitamine C, et nous considérerions alors que la durée de conservation est terminée. Si vous êtes un formulateur ou un fabricant, si vous avez une vitamine comme celle dont vous parliez, vous avez des allégations concernant la quantité de vitamine ou la puissance de votre produit. Vous baseriez la fin de la durée de conservation sur cette valeur.
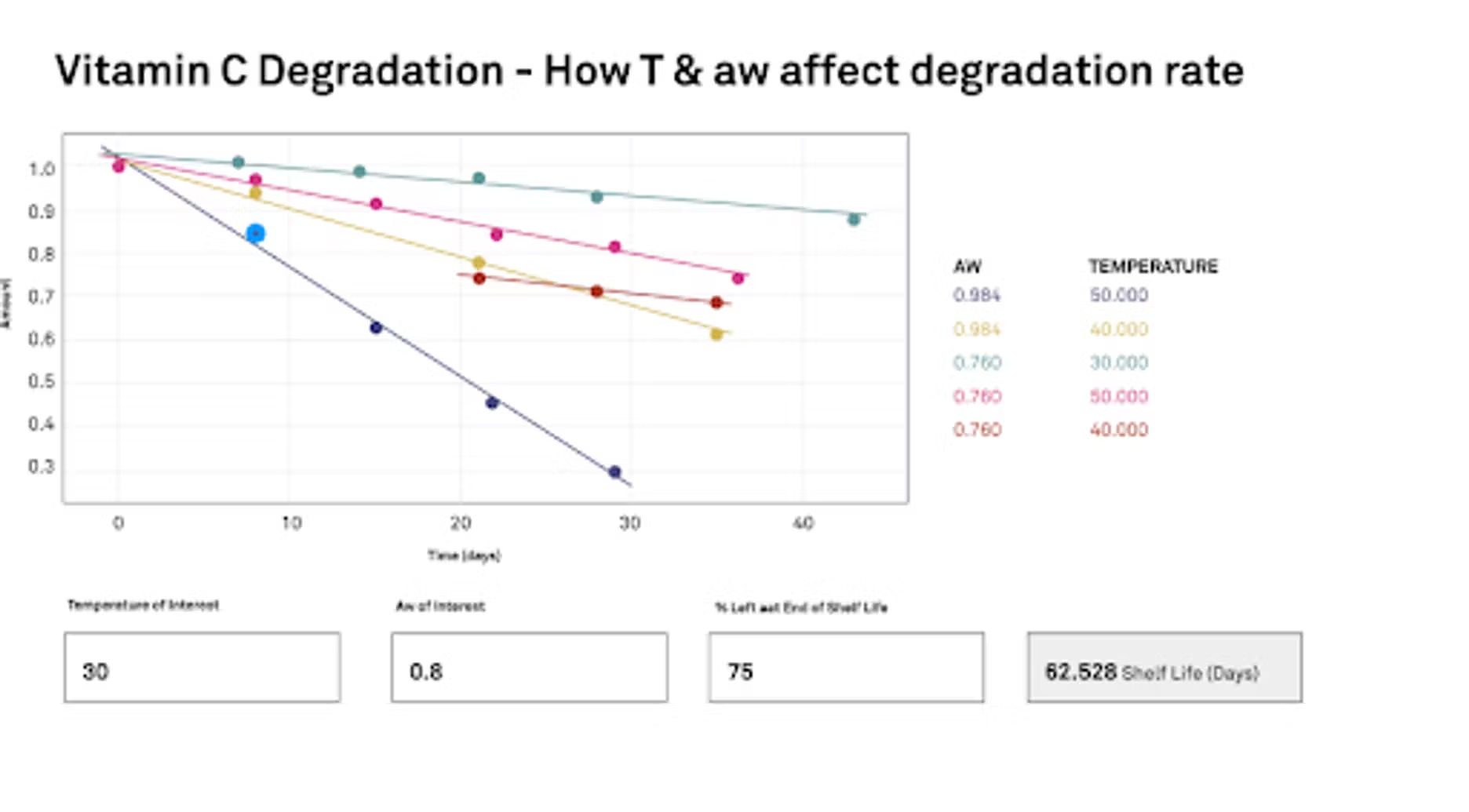
Une fois toutes ces informations saisies, le programme peut calculer la durée de conservation. Dans notre cas, avec l'acide ascorbique, si nous nous intéressons à une température de 30 °C et à une activité de l'eau d'environ 0,8, ce qui est assez élevé, mais une salle de bain remplie de vapeur pourrait atteindre ce niveau. Ce qui correspond à environ 80 % d'humidité relative. Comme je l'ai déjà dit, 75 % sera la limite. Nous disposerions de 62 jours avant que cet acide ascorbique ne perde toute son efficacité.
C'est essentiellement ainsi que fonctionne la stabilité chimique. Il suffit de la suivre, et si vous êtes capable de la mesurer, vous pouvez mener cette étude.
Zachary :
Il s'agit là encore d'un autre outil de la boîte à outils d'analyse de l'humidité, spécialement conçu pour la stabilité chimique. Même si la collecte des données peut prendre un certain temps, une fois celles-ci recueillies, il est facile de les représenter graphiquement dans la boîte à outils. Vous venez de montrer qu'il est possible d'entrer une activité de l'eau de départ, une température donnée, puis de définir la fin de la durée de conservation et d'obtenir rapidement des calculs. Même si la mise en place d'une étude peut prendre un certain temps, et qu'il s'agit d'études que nous pouvons réaliser ou pour lesquelles nous pouvons également guider nos clients à l'aide de chambres humides, une fois les données collectées, les calculs offrent une grande flexibilité et permettent d'obtenir de nombreuses informations. Dans votre cas, nous nous sommes intéressés spécifiquement à la vitamine C, mais cela pourrait s'appliquer à tout ce que nous pouvons mesurer, tout ce à quoi nous pouvons attribuer une valeur.
Marie :
Cela fonctionne dans les deux sens. Dans ce cas, il pourrait s'agir du taux de dégradation, mais vous pourriez également mesurer l'augmentation d'un élément, comme une réaction de brunissement ou quelque chose de similaire, qui s'intensifie avec le temps, et qui met fin à la durée de conservation. Il s'agissait peut-être d'une valeur de couleur spécifique. Peu importe, tant que vous pouvez la mesurer. S'il existe un moyen de suivre cette évolution, vous pouvez la convertir en taux et obtenir des graphiques comme celui-ci.
Zachary :
Il existe aujourd'hui tellement de compléments alimentaires et tellement de produits sous forme de poudre que l'utilisation de ce type d'outil pourrait les aider à comprendre quel est leur objectif en matière d'activité de l'eau, quelles sont les conditions de conservation ou ce qui met fin à leur durée de conservation. Quel pourcentage de perte d'une certaine vitamine ou comment peuvent-ils faire cette allégation qui figure sur leur étiquette ? Comment peuvent-ils en être sûrs ? C'est un bon moyen d'y parvenir.
Marie :
Encore une fois, l'exemple devant vous pourrait changer votre intérêt, vous pourriez changer votre intérêt. Vous pourriez changer la température et l'activité de l'eau qui vous intéressent, ou même la quantité que vous souhaitez obtenir au final. Tout cela est facile à modifier, il suffit de relancer la prédiction.
Caractérisation de la stabilité microbienne des poudres
Zachary :
Enfin, la stabilité microbienne. Beaucoup de poudres ont une faible activité hydrique, et parfois les gens ne se rendent pas compte qu'il peut y avoir un problème de sécurité. En effet, les poudres peuvent contenir des micro-organismes préoccupants et, même si elles sont sans danger, elles ne sont pas nécessairement stériles. Une fois la poudre réhydratée, si elle contient des spores ou des micro-organismes préoccupants, c'est à ce moment-là que des problèmes de sécurité peuvent apparaître. Je crois savoir que vous avez récemment contribué à un article et j'aimerais que vous nous parliez de son contenu.
Marie :
Vous l'avez très bien dit. On pense souvent que les aliments à faible teneur en humidité ne présentent aucun risque de prolifération microbienne et qu'il n'est donc pas nécessaire de connaître leur activité hydrique. Malheureusement, il y a eu de nombreux rappels d'aliments à faible teneur en humidité, notamment du beurre de cacahuète, de la farine, du lait maternisé, etc., qui ont été contaminés par des bactéries telles que E. coli et la salmonelle. C'est décourageant. C'est exactement le cas, car l'activité de l'eau est un excellent moyen de limiter la prolifération microbienne. Si l'activité de l'eau est inférieure à 0,6, rien ne se développe. Cela donne un faux sentiment de sécurité. Mon produit a une faible activité, je n'ai pas à m'inquiéter, mais l'activité de l'eau n'est pas une étape de destruction, comme vous le disiez, ce qui signifie que les micro-organismes sont toujours vivants, ils sont simplement en stase.
Si elles sont exposées à une humidité plus élevée ou à une activité hydrique plus importante, si vous ajoutez de la farine à la pâte à biscuits, ce que vous voudriez faire, vous créez alors un environnement dans lequel ces micro-organismes peuvent se développer et proliférer, et vous comprenez alors pourquoi la salmonelle, E. coli ou tout autre micro-organisme peut devenir dangereux pour la population. Il s'agit en fait d'un vaste sujet. Lorsque j'ai récemment assisté à une conférence sur la protection alimentaire, ce sujet a été largement abordé, avec de nombreuses sessions consacrées à ce thème. Actuellement, de nombreuses recherches sont également menées sur les moyens de stériliser ou de pasteuriser ces aliments à faible teneur en humidité. Des recherches sont en cours, et nous connaissons plusieurs chercheurs, tout comme vous, qui travaillent très activement sur ce sujet afin de trouver des moyens d'empêcher la croissance microbienne ou ces épidémies, et de pasteuriser ou stériliser ces aliments à faible teneur en humidité.
Zachary :
L'une des chercheuses avec lesquelles nous nous sommes récemment entretenus est le Dr Jennifer Acuff. Elle étudie les aliments à faible teneur en humidité et les environnements dans lesquels ils sont produits, et réfléchit à différentes méthodes ou techniques d'hygiène permettant d'empêcher la présence d'agents pathogènes d'origine alimentaire, même dans les aliments à faible teneur en humidité. Nous avons récemment enregistré un podcast avec elle, dans lequel elle aborde ce sujet. De mon point de vue, il est important de rester vigilant en matière d'hygiène et de veiller à ce que votre environnement soit aussi propre que possible. C'est un sujet dont nous avons également discuté récemment avec le Dr Minto Michael de l'université de l'État de Washington, en examinant la microbiologie et en comprenant qu'il existe différentes combinaisons de température, de temps et d'activité de l'eau, mais comme vous l'avez mentionné, vous ne pouvez pas chauffer tous les types d'aliments, car cela entraînerait des changements structurels.
Il existe peut-être d'autres moyens, comme le traitement par micro-ondes ou à haute pression, ou encore d'autres techniques que nous pouvons utiliser en combinaison avec la réflexion sur l'activité de l'eau afin de garantir que ces aliments soient aussi sûrs que possible. Si vous le souhaitez, vous pouvez écouter le podcast avec le Dr Acuff ou le Dr Michael pour en savoir plus sur la sécurité alimentaire.
Marie :
J'ai également réfléchi au rôle joué par l'activité de l'eau lors de l'étape de pasteurisation. Même si vous êtes en mesure de le faire, par exemple pour du bœuf séché ou un produit similaire, il existe une combinaison de température et d'humidité qui doit être respectée pour que cela soit efficace. L'autre aspect à prendre en compte est le suivant : si vous êtes en mesure de le faire, créez-vous un environnement permettant de tuer les micro-organismes qui vous intéressent ? Si vous respectez le temps et la température appropriés, mais que l'humidité est faible, la stérilisation ne sera pas aussi efficace. Tous ces facteurs entrent en ligne de compte, c'est certain.
Récapitulatif et recommandations
Zachary :
En bref :
- Aujourd'hui, nous avons examiné les poudres et avons tenté de les définir.
- Nous avons examiné la stabilité physique, chimique et microbienne.
- Nous avons parlé de certains des produits AQUALAB que nous avons utilisés pour faire des recherches et étayer ce dont nous avons discuté aujourd'hui.
Une chose que je voulais mentionner ici, c'est que même si nous proposons des solutions qui mesurent les produits finis ou les ingrédients, nous avons également une solution en ligne appelée SKALA Dry qui peut vraiment aider avec les produits séchés par atomisation.
Si vous rencontrez des difficultés à fabriquer un produit homogène en fonction de la température et des changements de saison, SKALA Dry peut vous aider automatiquement à obtenir le bon niveau d'activité de l'eau pour ce produit.
N'oubliez pas non plus d'écouter le podcast dont nous avons parlé, Water In Food. Nous avons également une chaîne YouTube. N'hésitez pas à l'écouter et à vous abonner.
À ce stade, nous allons ouvrir la séance aux questions.
1. Existe-t-il un moyen de mesurer ou de suivre l'hygroscopicité des poudres avec lesquelles je travaille ?
Zachary :
Excellente question. En ce qui concerne l'hygroscopicité, nous pouvons examiner la forme de la courbe isotherme. C'est un point que nous avons abordé précédemment, et que nous pouvons probablement reprendre maintenant, mais vous observez la pente des courbes.
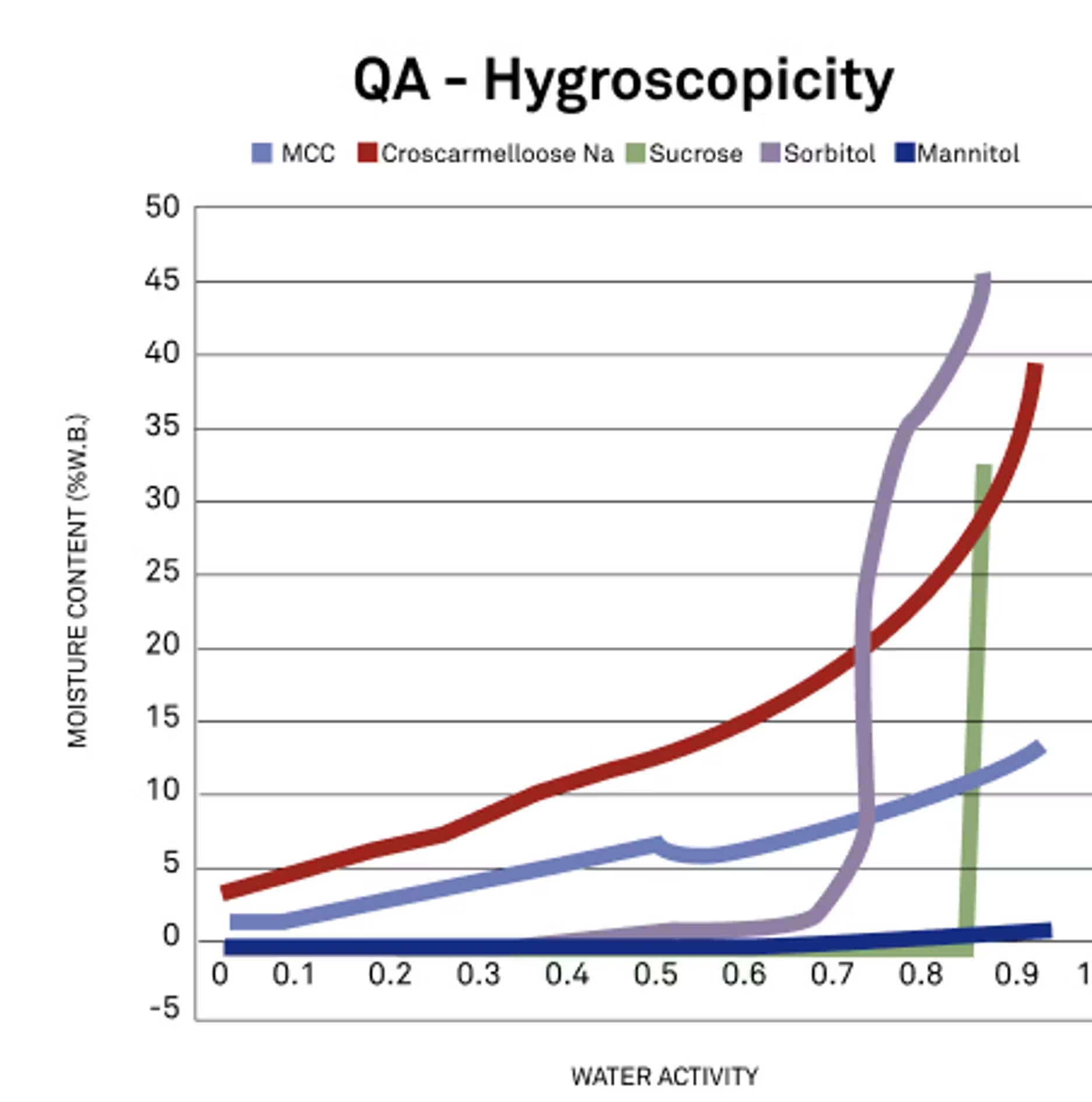
Dans ce cas, nous examinons différents excipients, et plus la pente de cette courbe est importante, plus l'hygroscopicité est élevée et plus la poudre spécifique absorbe ou retient l'eau. Il suffit de regarder la forme de cette courbe pour voir très rapidement et visuellement la différence d'hygroscopicité entre ces poudres. Je ne sais pas si vous avez quelque chose à ajouter.
Marie :
C'est une bonne explication. En gros, plus la pente est raide, plus le produit est hygroscopique, ce qui signifie également qu'il va apporter davantage d'humidité à votre produit final, quel qu'il soit. Il est essentiel de comprendre cette relation et le degré d'hygroscopicité d'un produit.
Zachary :
J'ajouterai simplement que, selon votre formule ou selon votre objectif ou résultat final, vous pouvez souhaiter ou non une pente plus importante. Le type de pente que vous recherchez dépendra uniquement du produit et de la formule.
Marie :
Si vous voulez un produit qui augmente ou se lie à l'eau comme vous le souhaitez, c'est une bonne méthode. Vous pouvez utiliser un ingrédient à forte pente qui absorbera beaucoup d'humidité et permettra d'ajouter beaucoup d'humidité à votre produit, puis vous pouvez formuler en fonction de l'activité hydrique spécifique que vous recherchez. Mais ce n'est pas nécessairement une mauvaise chose, c'est juste quelque chose à savoir.
2. Qu'est-ce qui a le plus influé sur la dégradation de la vitamine C, la température ou l'activité de l'eau ?
Marie :
D'accord, je vais répondre à cette question. L'activité de l'eau a clairement été le facteur principal dans la dégradation de la vitamine C, bien plus que la température. Si vous revenez en arrière et examinez les données, vous pourrez également le constater par vous-même, car si vous comparez les réactions obtenues en faisant varier uniquement la température et celles obtenues en faisant varier l'activité de l'eau, il apparaît très clairement que le facteur le plus important est l'activité de l'eau.
Zachary :
Cela dépendra spécifiquement de chaque vitamine, et c'est un sujet dont nous avons récemment discuté. Mais même si la vitamine C s'est comportée de cette manière spécifique, vous devrez examiner chaque vitamine ou chaque ingrédient actif, quel que soit celui qui vous intéresse. Ce ne sera pas toujours la tendance. Ce n'est pas toujours l'activité de l'eau qui aura la plus grande influence. Il faut mener ce type d'étude pour comprendre laquelle aura le plus grand impact.
Marie :
Exactement. Parce que cela pourrait être l'oxygène ou la vitamine E qui peuvent rancir. Vous pourriez suivre cela et avoir une réponse différente à ce sujet. Mais pour la vitamine C, c'était l'activité de l'eau.
3. Comment l'activité de l'eau ou la teneur en humidité influe-t-elle sur la vitesse de dissolution d'une poudre ?
Marie :
Je dirais que ce n'est pas nécessairement l'activité de l'eau ou la teneur en humidité en soi, mais plutôt la structure de la poudre elle-même, la vitesse à laquelle elle peut se dissoudre et l'environnement dans lequel elle se trouve. S'il s'agit d'une boisson en poudre, elle se trouvera dans un environnement à forte activité de l'eau, ce qui lui permettra de se dissoudre rapidement. Mais cela dépend. Par exemple, si vous avez un produit qui contient un hydrate, il contient généralement déjà de l'eau qui a tendance à se dissoudre plus rapidement. Tout dépend. Ce n'est pas aussi simple que de connaître l'activité de l'eau et la teneur en humidité d'une poudre, c'est plutôt une question de structure et de la rapidité avec laquelle elle peut se dissoudre.
Zachary :
J'ajouterai qu'en examinant également l'isotherme et en effectuant un test DVS, si vous êtes en mesure d'identifier un point de déliquescence ou un point où tout se dissout, nous pouvons alors utiliser un test DVS pour comprendre combien de temps cela va prendre. Peut-être en examinant la structure et en s'informant également à partir de l'isotherme.
Marie :
Exactement. Il est important que la poudre soit dissoute, car la plupart des poudres que nous avons testées sont censées l'être. Si vous avez simplement un mélange pour boisson, vous allez l'ajouter à autre chose. Mais que faire si vous voulez éviter qu'il ne s'agglomère et ne forme des grumeaux avant d'être emballé ? Nous avons tous déjà vécu cela ou avons déjà eu un mélange pour boisson ou autre chose, et c'est difficile. Nous avons peut-être examiné l'isotherme, nous allons déterminer quel est le point critique pour ce mélange, puis nous assurer que nous avons un emballage qui garantit qu'il ne le dépasse pas, ou peut-être devons-nous ajouter un agent anti-agglomérant ou quelque chose de ce genre. Tous ces facteurs influent sur la solubilité d'une poudre.
4. Quelle est la durée de conservation de la poudre amorphe par rapport à celle de la poudre cristalline ?
Zachary :
Tout dépendra de ce qui met fin à la durée de conservation. S'agit-il d'un changement de texture ou d'un changement chimique ? Nous devons d'abord définir à quoi ressemble ce point final, puis déterminer ce qu'il faudrait ajouter à cela.
Marie :
Bonne question. Les poudres cristallines ont un point de déliquescence, comme je l'ai mentionné. Je sais, encore une fois, qu'elles passent directement de l'état solide à l'état liquide, et cela dépend de l'humidité à laquelle elles sont exposées. Si vous parvenez à maintenir l'environnement autour de cette poudre cristalline en dessous de ce point, alors elle peut changer rapidement d'activité sans modifier la structure de la poudre. Vous pouvez obtenir une durée de conservation très longue. Pensez au saccharose, au NaCl ou à des substances similaires. Vous obtenez simplement une longue durée de conservation.
Mais si elle est supérieure, alors vous avez un problème. Contrairement à ce que vous avez dit, tout est important : qu'est-ce qui va déterminer la durée de conservation ? À quel environnement le produit va-t-il être exposé ? Alors, qu'est-ce qui est logique ? Nous avons également organisé un webinaire sur les édulcorants, et c'était très intéressant d'en savoir plus sur leurs caractéristiques de solubilité. Nous passons d'une structure amorphe à une structure cristalline, et la question de savoir comment cela peut précipiter hors d'un produit est très complexe. Y a-t-il une réponse claire ? Je vais essayer de simplifier les choses. Les structures cristallines, si vous pouvez les maintenir en dessous de ce point critique, vous pouvez les exposer à tout ce qui se trouve en dessous. En réalité, cela ne changera pas, car chaque interaction avec l'eau est comme une surface. Mais là encore, si c'est au-dessus de ce point, s'il s'agit d'une réaction chimique ou d'autre chose, alors c'est un autre sujet dont nous devons parler.
Zachary :
J'ajouterai simplement que pour les solides cristallins ou les poudres, leur point de déliquescence est généralement assez élevé, peut-être 0,9 d'activité de l'eau ou quelque part dans cette fourchette, alors qu'une poudre amorphe peut subir un changement physique entre 0,3 et 0,6 d'activité de l'eau. Si c'est uniquement la texture qui détermine la durée de conservation, j'imagine que la plupart des solides cristallins auront une durée de conservation plus longue. Mais si c'est la stabilité chimique ou la réaction chimique qui nous intéresse, il faudra approfondir la question et mener une expérience pour répondre à cette question.
Marie :
Revenons à l'autre aspect cristallin que nous n'avons pas mentionné : si nous avons des particules de petite taille, des structures ou des formes inhabituelles, ou des tailles variées, cela peut avoir un impact sur l'endroit où vous commencerez à obtenir ce pontage de manière inattendue à l'humidité ambiante. Même en disant que si vous maintenez le cristallin en dessous du point de déliquescence, vous êtes libre, la taille des particules aurait également un impact certain sur la stabilité de cette structure cristalline.
Inscription à la newsletter
Études de cas, webinaires et articles qui vous plairont.
Recevez régulièrement les derniers contenus !
